Introducción
Las tripanosomosis humanas son producidas por protozoos flagelados que viven en la sangre y tejidos del huésped humano, y son transmitidas por artrópodos hematófagos.
Existen dos enfermedades distintas con localizaciones geográficas diferentes: la americana y la africana.
TRYPANOSOMA BRUCEI
La tripanosomosis africana es causada por hemoprotozoarios flagelados: Trypanosoma brucei gambiense en África Central y Occidental, y Trypanosoma brucei rhodesiense en África Oriental y del Sudeste. Ambas (subespecies de Trypanosoma brucei) pasan parte de su ciclo biológico como parásito en la sangre de los seres humanos y de otros mamíferos. Les produce una enfermedad neurológica fatal, la tripanosomosis, cuyo estadio final en la personas es la enfermedad del sueño.
Agente etiológico, morfología y ciclo de vida
En la actualidad los agentes causales de la tripanosomosis africana, Trypanosoma brucei rhodosiense (Stephens y Fanthan, 1910) y Trypanosoma brucei gambiense (Dutton, 1902), se consideran como subespecies de Trypanosoma brucei, especie patógena para los animales, pero no para el hombre. Por sus diferencias morfológicas en la sangre de los vertebrados, se dice que este tripanosoma es polimorfo: algunos son largos y delgados; otros son cortos, anchos y sin flagelos; y otros intermedios. Tienen movimiento rápido y llegan a medir entre 15 a 40 µm de longitud. El tripomastigote tiene un núcleo central extracelular y un flagelo libre en la parte posterior. Presenta una membrana ondulante y un flagelo libre en la parte anterior. En preparaciones coloreadas, se observan ciertas granulaciones que se tiñen de azul pálido y se conocen como gránulos de volutina.
Existen otros detalles que nos permiten diferenciar ambas formas infectantes: T.b. gambiense es más adaptable a los humanos y es difícil hacerla crecer en animales de laboratorio; mientras T.b rhodesiense es más virulenta para el humano e infecta animales de laboratorio con facilidad. Además es frecuente observar polimorfismo en la infección por T.b rhodesiense y menos en T.b gambiense.
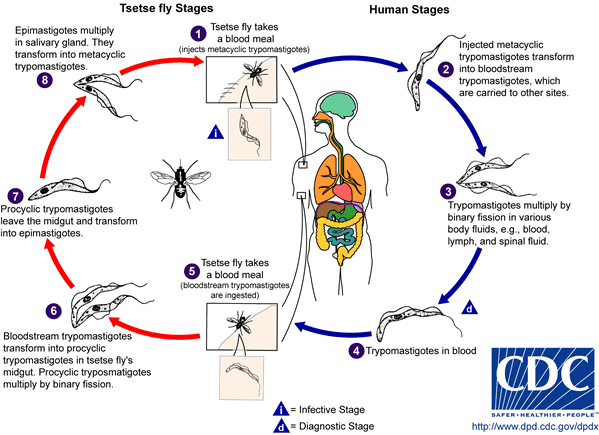
En la evolución de T. brucei y las subespecies parásitas del hombre, hay un huésped vertebrado (ganado doméstico y el hombre) y un huésped invertebrado (mosca hematófaga del género Glossina: tsetsé), que se infecta al picar a una persona o a un animal que tiene en su sangre al parásito. Una vez ingerido los tripomastigotes, se reproducen activamente en el intestino medio y posterior de los insectos y toman forma de epimastigotes; en un lapso de 20 a 40 días emigran a las glándulas salivales, en especial a los conductos. En este sitio se adhieren al epitelio, se dividen nuevamente y en otra picadura de la mosca son transmitidas al hombre o a un animal susceptible. En el huésped vertebrado, los tripomastigotes se multiplican por división binaria en la sangre y los tejidos. Después de infectada la mosca, permanece así por el resto de su vida (hasta 11 meses)
Patología
En el sitio de la picadura de la mosca se produce una reacción inflamatoria localizada, parecida a un furúnculo, que dura de 1 a 2 semanas. Los parásitos invaden la sangre circulante con parasitemia muy notoria. Posteriormente hay invasión a los ganglios linfáticos, donde se produce reacción inflamatoria y proliferación de células endoteliales; la infiltración leucocitaria es de localización presvascular y finalmente en los ganglios se produce fibrosis.
El hígado y el bazo aumentan de tamaño y se vuelven congestivos con infiltrado reticuloendotelial. Después de 3 meses más, el parásito llega al SNC y se produce una meningoencefalitis difusa con edema cerebral y pequeñas hemorragias. En el microscopio se pueden observar proliferación de las neuroglias y células mononucleadas.
El líquido cefalorraquídeo está turbio con proteínas aumentadas y abundantes células mononucleadas. Se pueden hallar parásitos en el tejido subyacente.
Manifestaciones clínicas
En el sitio de la picadura de la mosca, se produce una reacción inflamatoria indurada y dolorosa (chancro de inoculación); luego de un periodo de incubación de 1 a 3 semanas aparecen las primeras manifestaciones clínicas de la enfermedad que se van instalando lenta pero progresivamente.
El período agudo de la enfermedad se caracteriza por un aumento de la parasitemia, seguido de fiebre, astenia, cefalea, dolores articulares, calambres musculares y, algunas veces, eritemas papulares. Entre los episodios febriles, hay períodos libres de síntomas, de hasta 2 semanas de duración. Los ganglios linfáticos crecen (aparecen en 75% de los pacientes), en especial los del cuello, submaxilares y mesentéricos; son móviles y blandos, pero después se tornan duros y fibróticos. El crecimiento de los ganglios linfáticos cervicales posteriores le da al cuello un ensanchamiento característico, que se conoce como el signo de Winterbotton o de lesión invernal, típico de la tripanosomosis por T.b gambiense, lo que no ocurre en T.b rhodesienese ya que esta linfadenopatía cervical es parte complementaria de la linfadenopatía generalizada.
En esta etapa puede observarse hepatomegalia y esplenomegalia. Es frecuente el edema periférico, pulmonar, derrame pleural y pericardico y la neumonía intercurrente. Puede aparecer cardiopatía y causar insuficiencia cardíaca y congestión pulmonar. En la fase crónica de la enfermedad, hay toma del SNC y el cuadro clínico es de una meningoencefalitis, que se instala lenta y progresivamente.
La cefalea es intensa, aparecen insomnio, bulimia, anorexia, coreoatetosis, hiper hipotonía, epilepisia o dificultad en la coordinación motora, incluyendo marcha anormal y ataxias. Es común encontrar hiperreflexia o que sean anormales los reflejos de Babinski, Hoffmann y otros del tallo cerebral arcaico. Hay manifestaciones sensoriales como hiperestesia (signo de Kérandel), y cambios mentales como depresión o euforia.
Todas estas manifestaciones que caracterizan a la enfermedad imposibilitan al paciente hasta para comer, lo que provoca desnutrición severa. Finalmente el enfermo entra en coma profundo y muere por paro respiratorio, para cardíaco o infecciones intercurrentes. Cuando no reciben tratamiento, las dos formas de enfermedad del sueño son mortales. En la subespecie T.b rhodesiense la muerte ocurre casi siempre entre 3 a 6 meses después de iniciada la enfermedad.
Diagnóstico
Para el diagnóstico clínico se toma en cuenta si el enfermo procede de una zona endémica y si fue picado por la mosca setsét.
El diagnóstico de laboratorio se basa en lo métodos directo e indirecto. Entre los directos se hallan: examen de sangre en fresco, tinción de frotis y gota gruesa con Giemsa del LCR, médula ósea y aspirado del chancro inicial o del ganglio linfático. Cuando no es posible visualizar el parásito, se pueden emplear cultivos o inoculaciones a roedores o primates. Existe métodos de concentración por centrifugación o ultrafiltración. Como métodos indirectos, la inmunofluorescencia indirecta es el método indirectos, la inmunofluorescencia indirecta es el método serológico más empleado y la reacción de inmunoprecipitación en gel, en sangre o en el LCR, para investigar anticuerpos IgM específicos. En los casos crónicos, además de la búsqueda del parásito en LCR, se deben observar otras alteraciones, como es el aumento de las células, en especial las monocleadas.
Epidemiología y prevención
Unos 50 000 000 de personas corren el riesgo de contraer la enfermedad. Cada año se contabilizan unos 20 000 casos nuevos. Aún más importante que el reto directo a los seres humanos, lo que es el hecho de que los animales domésticos sean susceptibles a la tripanosomosis, lo que constituye un serio problema en el desarrollo de la industria agropecuaria.
La enfermedad está limitada al continente africano, por la existencia de los vectores apropiados: T.b rhodesiense es transmitida fundamentalmente por Glossina morsitans, que tiene su hábitat en las sabanas de la parte oriental de África Central y Occidental.
Las moscas del género Glossina se identifican principalmente por poseer proboscis picadora, tanto en los machos como en las hembras, Las picaduras ocurren durante las horas de día; y las moscas pueden ser diferenciadas, a pesar de ser en forma y tamaño similares a las moscas domésticas, por la presencia de una celda discal en las alas, que tiene la forma de hacha de carnicero.
Esta moscas son vivíparas, producen larvas maduras que forman ninfas una vez que las larvas ha sido enterradas en suelo arenoso. Requieren de humedad, sombra y temperatura promedio entre 20 y 30°C, además de la presencia de mamíferos como fuente de alimentos; son capaces de volar hasta 20 km en busca de alimento.
Tratamiento
Actualmente se combate la mosca tsetsé, y se trata de modificar su entorno ecológico con la tala de los árboles y vegetación, el uso de insecticidas y el tratamiento de los reservorios, tanto humanos como animales. Como profilaxis individual se utilizan los repelentes.
La mayoría de las drogas utilizadas para combatir la enfermedad no es efectiva y, además produce reacciones secundarias tóxicas y severas; sin embargo, reducen la mortalidad y previenen los daños neurológicos si son administradas al comienzo de la infección, cuando no haya invadido el SNC.
Drogas de elección
Suramina. En la fase aguda de la enfermedad, antes de la encefalitis, comprobada con LCR normal, se aplica por vía endovenosa a la dosis de 4mg/Kg el primer día; 10mg/kg el ter día; 20mg/kg los días 7; 14 y 21 sin pasar de 1g. La suramina tiene algunos efectos secundarios como náuseas, vómitos, convulsiones y estado de choque.
Melarsoprol. Se administra cuando ya existe compromiso del SNC. Se recomiendan de 2 a 3,6 mg/kg/día dividida en tres dosis por 3 días. Este medicamento es altamente tóxico, por lo que se debe chequear el funcionamiento hepático y renal.
En los pacientes con mal estado general, se comienza la terapia con suramina y luego con el melarsoprol.
Pentamidina. Es considerado actualmente como el medicamento de elección. Se administran 4mg/kg/día por vía intramuscular o endovenosa, con un total de 10 dosis. Es efectiva en la etapa aguda de la infección por T.b gambiense, no así para las cepas resistentes ni para T.b rhodesiense. No atraviesa la barrera encefálica y puede provocar hipotensión, hipoglucemia y en altas dosis es hepatóxica y nefrotóxica.

No hay comentarios.:
Publicar un comentario